Р. П. Бете, Campden and Chorleywood Food Research Association
Введение
Выявление и определение численности микроорганизмов в пищевом продукте или на поверхностях, вступающих с ним в контакт, является неотъемлемой составной частью любого контроля и системы оценки качества. Микробиологические тесты пищевых продуктов можно разделить на два типа: а) количественные, в которых группы микроорганизмов в пробе подсчитываются, а результат выражают в виде количества присутствующих организмов на единицу массы пробы, и б) качественные («присутствие/ отсутствие»), которые сводятся к обнаружению наличия или отсутствия определенного микроорганизма в известной массе пробы.
Основа методов, используемых для обнаружения микроорганизмов в пищевых продуктах, хорошо известна и опирается на введение пищевого продукта в питательную среду, в которой микроорганизмы могут воспроизводиться, что приводит к их видимому росту. Такие методы просты, гибки, удобны и обычно дешевы, но у них есть два недостатка: во-первых, тесты основаны на росте микроорганизмов в среде, что может занять много времени и ведет к большой длительности теста; во-вторых, методы ориентированы на их выполнение вручную и поэтому трудоемки.
В последние годы выполнен большой объем исследований в области ускоренных автоматизированных микробиологических методов (экспресс-анализа). Цель этих работ заключалась в уменьшении продолжительности тестов (путем применения методов, отличных от выращивания микроорганизмов для обнаружения и/или подсчета микроорганизмов) и в снижении трудоемкости (путем максимально возможной автоматизации). Разработанные автоматизированные экспресс-методы получили некоторое признание в пищевой промышленности и могли бы сформировать важный инструмент контроля качества охлажденных продуктов. Результаты экспресс-анализа могут увеличить срок хранения охлажденных продуктов на один-два дня по сравнению с традиционной микробиологической методикой. Кроме того, наличие ускоренных методов микробиологического экспресс-анализа указывает на наличие возможности управления в реальном масштабе времени и их применения в системе оценки качества по методике НАС СР.
Отбор проб
Хотя в данной главе рассматриваются методы, применяемые для испытаний пищевых продуктов, для микробиолога особенно важен вопрос отбора проб. Независимо от того, насколько хорош конкретный метод, если проба взята неправильно и не является репрезентативной для партии продукта, из которого она взята, результаты теста не имеют смысла. Полезно разработать план выборочного контроля, в котором результаты определяются на основе ряда анализов, а не по одному результату. В настоящее время микробиологи обычно используют планы выборочного контроля с двумя или тремя наборами проб, в которых указывается количество индивидуальных тестируемых проб из одной партии (наряду с действующими микробиологическими пределами). Такие планы выборочного контроля детально описаны в работе [2].
После того, как разработан план выборочного контроля, представительная порция продукта должна быть взята для анализа. Для этого микробиолог должен достаточно детально разбираться в продукте и его микробиологии. Многие охлажденные продукты не являются однородными смесями, а состоят из слоев или частей (хорошим примером может служить готовый сэндвич). Следует решить, необходим ли микробиологический результат для целого сэндвича (то есть хлеба и начинки), только для хлеба или только для начинки. И действительно, в некоторых случаях может оказаться необходимым проверять одну часть смешанной начинки. После принятия решения может быть взят образец для анализа с помощью соответствующего асептического метода и стерильных средств отбора проб [76]. После разработки процедуры отбора проб микробиолог может быть уверен, что взятые пробы являются представительными пробами проверяемого продукта, а методам проверки можно доверять.
Традиционные микробиологические методы
Как показано во введении к данной главе, традиционные микробиологические методики основаны на общепризнанном методе: пробы пищевого продукта помещают в питательную среду и в течение некоторого времени выдерживают там для роста микроорганизмов. Определение микроорганизмов или их подсчет затем осуществляют путем обычной визуальной оценки роста культуры. Эти методы технически просты и относительно дешевы, поскольку не требуют сложного оборудования. При этом они легко могут быть приспособлены для определения количества микроорганизмов различных групп.
Перед тестированием образцы пищевого продукта должны быть переведены в жидкую форму, чтобы их можно было смешать со средой для выращивания. Это обычно делается так: пробу точно отвешивают в стерильный сосуд и добавляют известный объем стерильного растворителя (соотношение пробы к растворителю обычно составляет 1:10); затем полученную смесь гомогенизируют с помощью гомогенизатора, который дробит пробу, и при этом все микроорганизмы попадают в раствор. Здесь важен правильный выбор растворителя — если на микроорганизмы в пробе отрицательно действуют неправильно выбранное значение pH или низкое осмотическое давление, они могут оказаться поврежденными или погибнуть, что повлияет на конечный результат микробиологического теста. Растворитель должен быть хорошо буферирован при pH, соответствующем тестируемому продукту, и быть осмотически уравновешен. При тестировании некоторых продуктов (например, сушеных), которые могут содержать микроорганизмы, подвергшиеся сильному отрицательному воздействию перед началом теста, может потребоваться определенный период для их восстановления, чтобы клетки не погибли в его начальной фазе [39].
Традиционные количественные методы
Подсчет количества микроорганизмов в пробах обычно производится методом подсчета на пластинке или методом наиболее вероятного числа (MPN). Наиболее широко применяется первый из этих методов, а второй обычно используется лишь для определенных микроорганизмов (например, Escherichia coli) или их групп (например, колиформ).
Метод подсчета на пластинке
Метод подсчета на пластинке основан на помещении пробы в слой агара в чашке Петри или на него. Отдельные микроорганизмы или небольшие их группы занимают в агаре отдельное место, и после инкубации вырастают, образуя отдельные колонии, количество которых подсчитывают визуально. Для подсчета количества различных видов микроорганизмов можно использовать различные виды агаровой среды. Использование неселективной питательной среды, которая выдерживается при 30 °С в аэробных условиях, даст общий счет жизнеспособных микроорганизмов, или мезофильный аэробный счет. Изменяя условия инкубации на анаэробные, получают общий анаэробный счет. Изменение температуры приведет к изменениям типов микроорганизмов, способных к росту, демонстрируя некоторую гибкость традиционного подхода с применением агара. Если присутствует требование определить в пробе количество микроорганизмов определенного типа, то чтобы сделать возможным рост только нужного типа микроорганизмов, в большинстве случаев необходимо изменить состав среды. Существует три подхода к созданию среды, позволяющих создать специальные среды: элективные, селективные и дифференциальные процедуры.
Элективные процедуры — это такие, при которых в среду включают реагенты или используют условия роста, способствующие развитию определяемых микроорганизмов, но не подавляющие рост других. Такими реагентами могут служить сахара, аминокислоты или другие факторы роста. К селективным процедурам относят процедуры включения реагентов или использование условий роста, подавляющих развитие микроорганизмов, отличных от определяемых. Следует отметить, что во многих случаях селективные факторы будут также отрицательно влиять на рост определяемых микроорганизмов, но это влияние будет меньше их влияния на другие клетки. Примерами селективных процедур являются введение в среду антибиотиков или использование анаэробных условий роста. Наконец, дифференциальные процедуры позволяют различить микроорганизмы по тем реакциям, которые их колонии вызывают в среде. Примером может служить введение в среду индикатора pH, чтобы отличить микроорганизмы, образующие кислоту. В большинстве случаев среда будет использовать систему с комплексным подходом, содержащую элективные, селективные и дифференциальные компоненты, чтобы пользователь мог идентифицировать и подсчитать определяемый микроорганизм.
Количество доступных в настоящее время типов агара слишком велико, чтобы даже просто их перечислить. Их характеристики следует искать в справочных руководствах фирм, выпускающих эти среды (например, Oxoid, LabM, Difco, Merck).
Метод MPN
Вторая из упомянутых выше процедур подсчета — это метод MPN, который позволяет оценить количество жизнеспособных микроорганизмов в пробе на основе статистического метода. Оценку получают, готовя десятикратные разбавления пробы и перенося полученные пробы каждого разбавления в три (обычно) пробирки питательной среды. Эти пробирки выдерживают, и те, в которых наблюдается какой-либо рост (помутнение), фиксируют и сравнивают со стандартной таблицей результатов [2], в которой указан уровень заражения продукта.
Этот метод используют только для некоторых видов тестов, так как он более трудоемок и требует больше материалов, чем метод подсчета на пластинке. Кроме того, границы доверительного интервала велики, и таким образом, этот метод обычно менее точен, чем метод подсчета на пластинке.
Традиционные качественные методы
Качественные процедуры используются тогда, когда знать количество микроорганизмов в пробе не требуется, а требуется лишь выяснить, присутствуют они или отсутствуют. Обычно такие методы используются для определения потенциально патогенных микроорганизмов, таких как Salmonella, Listeria, Yersinia и Campylobacter. Для выполнения анализа необходимо гомогенизировать точно взвешенную пробу (обычно 25 г) в первичном питательном бульоне и выдержать в течение заданного времени при заданной температуре. В некоторых случаях проба после первичного бульона может требовать переноса во вторичный питательный бульон и дополнительной выдержки (инкубации). Полученный продукт обычно наносят на селективную агаровую пластинку, на которой возможен рост определяемого микроорганизма. Длительная процедура выращивания используется потому, что проба может содержать очень мало определяемых микроорганизмов и большое количество «фоновых». Кроме того, в обработанных продуктах определяемые микроорганизмы могут находиться в поврежденном состоянии, и поэтому методы выращивания делают возможным восстановление поврежденных клеток и их последующее избирательное выращивание в присутствии большого числа конкурирующих микроорганизмов.
Определяемый микроорганизм в бульонной культуре обычно незаметен, поэтому бульон необходимо наносить на селективную/дифференциальную агаровую пластинку. Затем микроорганизмы можно обнаружить по появлению их колоний. Образование типичных для определемых микроорганизмов колоний на агаре описывается как предполагаемые колонии. Для подтверждения того, что эти колонии состоят из определяемых микроорганизмов, обычно проводят дополнительные биохимические и серологические определения на чистых культурах микроорганизма. Это обычно требует, чтобы для обеспечения чистоты колонии с пластинок первичного выделения были вновь перенесены. Очищенные колонии затем проверяют биохимически, выращивая их в среде, которая показывает, производит ли микроорганизм определенные ферменты или использует ли определенные сахара.
В настоящее время ряд фирм продает миниатюрные системы для биохимического тестирования, позволяющие микробиологам быстро и просто выполнять биохимические экспресс-определения или автоматические тесты. Серологические тесты выполняются на чистых культурах некоторых выделенных микроорганизмов (например, Salmonella) с использованием промышленно выпускаемых антисывороток.
Экспресс-методы и автоматические методы
Общий интерес к новым микробиологическим методам частично определяется возросшим объемом производства пищевых продуктов. Это приводит к:
- увеличению объема хранящихся проб до получения положительного результата (снижение времени анализа снизило бы складские издержки);
- увеличению количества анализируемых в лаборатории проб (единственная возможность их обработки — это увеличение размеров лабораторий и их штата, а также применение более ускоренных автоматизированных методов);
- более продолжительному сроку хранения охлажденных продуктов (сокращение времени анализа могло бы ускорить выпуск продукции и тем самым увеличить срок хранения продукта);
- росту применения процедур НАССР (экспресс-методы могут применяться в процедурах проверки качества по методу НАССР).
Существует несколько методов, носящих название «экспресс-методов», причем большинство из них сильно отличаются как друг от друга, так и от традиционных процедур, которые они заменяют. Эти методы можно разделить на количественные и качественные тесты, причем первые дают значение количества микроорганизмов в пробе, а вторые указывают лишь на их присутствие или отсутствие. В лабораториях, где рассматривается вопрос использования экспресс-методов для стандартных (рутинных) испытаний, следует тщательно определить свои требования перед покупкой той или иной системы ускоренного анализа. Каждый новый метод уникален и дает несколько отличный от других результат, у него определенные временные характеристики, уровень автоматизации и производительность. Кроме того, некоторые методы плохо работают с определенными видами продуктов или не могут выявить определенные микроорганизмы или группы, которые требуется определять. Все эти моменты необходимо учитывать перед принятием решения о включении того или иного метода в арсенал лаборатории. Важно также, чтобы персонал, использующий новые методы, понимал принципы, которые лежат в их основе, а значит, при явно неверных результатах мог бы обнаружить причину их получения.
Электрические методы
Определение количества микроорганизмов в растворе может быть достигнуто двумя электрическими методами, один из которых определяет количество и размер частиц, а другой контролирует их метаболическую активность.
Подсчет частиц
Подсчет и определение размера частиц могут быть выполнены на основе принципа «Coulter» с использованием счетчика Coulter Counter (компании Coulter Electrics, г. Лутон, Великобритания). Метод основан на пропускании электрического тока между двумя электродами, помещенными по сторонам перегородки с небольшим отверстием. Когда частицы или клетки, взвешенные в электролите, проходят через отверстие, они вытесняют объем электролита, равный им по объему, вызывая падение электропроводности по постоянному току, которое зависит от размера клетки. Эти изменения в проводимости определяются прибором и могут быть преобразованы в последовательность импульсов напряжения, причем амплитуда каждого импульса пропорциональна объему частицы, а количество импульсов соответствует количеству частиц.
Этот метод широко используется в исследовательских лабораториях для экспериментов, требующих определения размера клеток или их распределения, а также применение в клинической микробиологии, где требуется определение бактерий [1]. В пищевой микробиологии этот метод, однако, до сих применялся мало. Имеются отчеты по определению количества клеток в молоке [49] и определению дрожжей в пиве [83], но о других исследованиях информации явно недостаточно. Любое применение подсчета частиц в пищевой микробиологии было бы, вероятно, ограничено невязкими жидкими пробами или жидкостями, свободными от взвешенных частиц, так как очень малое количество пробы может вызвать значительные искажения результатов и засорение отверстия.
Метаболическая активность
В работе [123] впервые было сообщено об использовании электрических измерений для контроля роста микроорганизмов. Автор использовал измерения проводимости для контроля разложения крови, и пришел к заключению, что электрические изменения вызывали ионы, образованные при бактериальном разложении составляющих крови. После этого первого отчета применение электрических измерений для контроля роста микроорганизмов изучалось рядом исследователей, и их работа в основном была успешной. Тем не менее этот метод не получил широкого распространения до тех пор, пока не стали доступны надежные приборы, способные контролировать электрические изменения в культурах микроорганизмов.
В настоящее время выпускается четыре прибора для определения микроорганизмов с помощью электрических измерений. Система Malthus System (IDG, г. Бэри, Великобритания), основанная на работе [105], контролирует изменения проводимости, происходящие в среде для выращивания, аналогично системе Rabit System {Don Whitley Scientific, Йоркшир). Устройства Bactometer(bioMerieux, г. Бэйзингсток, Великобритания) и Batrac (SyLab, г. Пуркерсдорф, Австрия) [6] могут контролировать как активную проводимость, так и емкостное сопротивление. Все эти приборы имеют одинаковые основные компоненты:
а)инкубаторную систему для хранения проб при постоянной температуре в ходе испытания;
б) контрольный блок, измеряющий активную проводимость и/или емкостное сопротивление каждой ячейки через регулярные интервалы (обычно каждые 6 мин);
в) компьютерную систему обработки данных, представляющую результаты в удобном для использования формате.
Определение роста микроорганизмов с помощью электрических систем основано на измерении ионных изменений, происходящих в среде из-за метаболизма микроорганизмов. Изменения, вызванные метаболизмом микроорганизмов, и электрохимические процессы, используемые в этих системах, довольно детально описаны в литературе [23, 45, 46]. Принцип заключается в том, что при росте и метаболизме бактерий проводимость среды возрастает. Электрические изменения, вызываемые малым количеством бактерий, невозможно определить, используя выпускаемые в настоящее время приборы. Чтобы изменения можно было зарегистрировать, в 1 мл должно присутствовать примерно 106 микроорганизмов. Это величина известна как предел обнаружения, а время, необходимое для достижения этого момента, называется временем обнаружения.
При использовании электрических систем для определения числа микроорганизмов в пищевых продуктах проба должна быть сначала гомогенизирована. Гомогенизированную пробу помещают в находящуюся в приборе ячейку или пробирку со средой для выращивания и подключают к ней контрольный блок инкубационной камеры или термостата. Электрические свойства среды для выращивания записываются в течение периода инкубации. Сосуд с пробой — это обычно стеклянная или пластмассовая пробирка или ячейка, в которые помещены два электрода. Пробирку наполняют подходящей средой для выращивания микроорганизмов и добавляют в нее гомогенизированную пробу пищевого продукта. Электрические изменения, происходящие в среде для выращивания при метаболизме микроорганизмов, контролируются с помощью электродов и регистрируются прибором.
При росте и в ходе метаболизма микроорганизмов в среде образуются новые вещества. Обычно незаряженные или слабозаряженные субстраты превращаются в сильно заряженные конечные продукты [44], увеличивая активную проводимость среды. Рост некоторых микроорганизмов (например, дрожжей) не приводит к значительному росту проводимости, что, вероятно, связано с тем, что эти микроорганизмы не производят ионизированных метаболитов, а это может вести к снижению проводимости при росте.
При использовании прибора для измерения импеданса электрическое сопротивление среды для выращивания записывается автоматически в течение инкубационного периода через регулярные интервалы (например, через 6 мин). Когда обнаруживается изменение контролируемого электрического параметра, истекшее время с начала испытания вычисляется компьютером и обычно отображается как время обнаружения. Полная кривая изменений электрического параметра во времени (см. рис. 8.1) подобна кривой бактериального роста, которая имеет сигмоидальную форму с тремя участками:
а)неактивная область, где все электрические изменения лежат ниже порога обнаружения прибора;
б)активная область, где происходят быстрые электрические изменения и
в)стационарная область или область спада, расположенная непосредственно после активной области и указывающая на замедление электрических изменений.
Не следует рассматривать кривую электрического отклика как подобие кривой роста микроорганизмов. Считается [45], что лаг-фаза и логарифмическая фаза роста микроорганизмов приходятся на неактивную и активную области кривой электрического отклика, до порога обнаружения прибора и за ним. Логарифмическая и стационарная фазы бактериального роста соответствует активной области и области спада кривых электрического отклика.
При использовании данных о времени обнаружения, полученных с помощью электрических приборов, для оценки микробиологического качества пробы продукта необходимо выполнить калибровку. Калибровка заключается в тестировании проб с помощью традиционного теста с пластинками и электрического теста. Результаты представляются графически, причем традиционный результат — на оси у, а время обнаружения — на оси х (см. рис. 8.2). В результате получается отрицательная кривая с
Рис. 8.1. Кривая активной проводимости, полученная при росте бактерий в благоприятной среде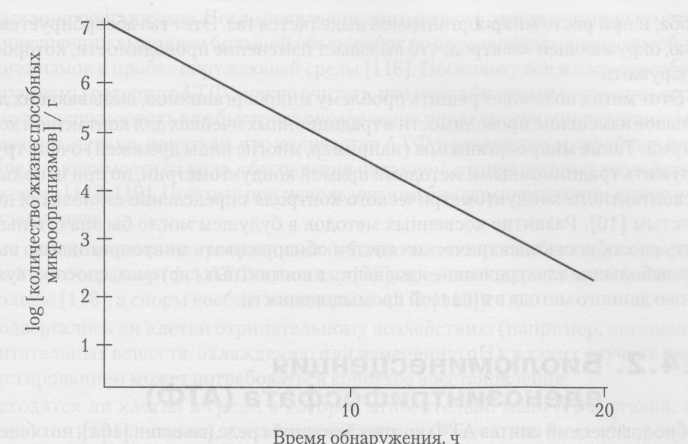
Рис. 8.2. Калибровочная кривая, показывающая изменения времени обнаружения по проводимости и общее количество жизнеспособных микроорганизмов
данными, охватывающими 4-5 логарифмических циклов микроорганизмов при коэффициенте корреляции более 0,85 [45]. Калибровки должны быть выполнены для каждого вида пробы, тестируемого с помощью электрических методов; различные пробы будут содержать разные виды микрофлоры с различными скоростями роста. Если калибровка выполнена неправильно, то это может существенно повлиять на время обнаружения и привести к неверным результатам.
До сих пор мы рассматривали применение электрических приборов для оценки общей численности микроорганизмов. Эти системы, однако, основаны на использовании среды для выращивания, и поэтому позволяют с помощью специально подобранных сред разработать методы оценки численности или обнаружения определенных микроорганизмов или их групп. Существует достаточно работ, посвященных электрическим измерениям для выявления/определения количества конкретных микроорганизмов. Так, Enterobacteriaceae посвящены работы [34,95], Pseudomonas — [7], Yersinia enterocolitica — [132], дрожжам — [31], E.coli — [42], a Campylobacter — [24].
В будущем количество видов определяемых микроорганизмов, несомненно, увеличится. В настоящее время проводится большой объем исследований по средам для определения Listeria, после чего начнут появляться среды для других микроорганизмов.
Большинство описанных выше эклектических методов основаны на использовании контактного измерения, то есть электрические изменения контролируются с помощью электродов, погруженных в среду культивирования. Некоторые авторы [93] указывали на потенциальные возможности бесконтактной кондуктометрии для определения микроорганизмов. При этом среда для выращивания расположена в одном отсеке ячейки, а электрод в другом. Жидкость, окружающая электрод, поглощает газ (например, для углекислого газа — это гидроксид калия). В среду для выращивания помещается
проба, и при росте микроорганизмов выделяется газ. Этот газ абсорбируется жидкостью, окружающей электрод, что вызывает изменение проводимости, которое можно обнаружить.
Этот метод позволяет решить проблему микроорганизмов, вызывающих лишь небольшое изменение проводимости в традиционных ячейках для контактной кондуктометрии. Такие микроорганизмы (например, многие виды дрожжей) очень трудно обнаружить традиционными методами прямой кондуктометрии, но при использовании бесконтактного кондуктометрического контроля определение становится довольно простым [10]. Развитие косвенных методов в будущем могло бы значительно улучшить способность электрических систем обнаруживать микроорганизмы, вызывающие небольшие электрические изменения в контактных системах, способствуя применению данного метода в пищевой промышленности.

Останні коментарі