Кислоты добавляют при производстве некоторых кондитерских изделий для придания им вкуса, присущего фруктам и ягодам.
Для этой цели применяют винную (виннокаменную), лимонную, молочную и яблочную кислоты. Все эти кислоты, за исключением молочной, кристаллические.
Товарная молочная кислота представляет собой раствор с концентрацией молочной кислоты 40—70%.
Употребляемые в кондитерской промышленности кристаллические кислоты взаимозаменяемы; применение молочной кислоты ограничено. Она употребляется в таких изделиях, где введение в продукт влаги вместе с кислотой не ухудшает его качества и не усложняет технологического процесса, например, для подкисления фруктовых масс в конфетном производстве, мармеладном и фруктовых карамельных начинок.
Ощущение кислого вкуса объясняется наличием ионов водорода. Тем не менее при определении коэффициентов взаимозаменяемости различных кислот нельзя исходить только из степени их диссоциации. Установлено, что чем слабее кислота, тем ниже концентрация водородных ионов, при которой начинает ощущаться кислый вкус (порог ощущения).
В табл. 87 приведены значения порога ощущения (по Писареву) и константы диссоциации кислот, применяющихся в кондитерском производстве.
Таблица 87. Порог ощущения кислот и константы диссоциации
| Кислоты | Константа диссоциации | Порог ощущения | ||
| pH | молярная концентрация кислоты ММОЛ в 1 л | количество кислоты в г в 100 мл раствора | ||
| Молочная | 1,37*10-4 | 3,45 | 2.7 | 0,0245 |
| Винная | 1,04*10-3 | 3,35 | 1.2 | 0,0160 |
| Лимонная | 8,4*10-4 | 3,32 | 0,93 | 0,0178 |
| Яблочная | 3,9*10-4 | 3,19 | 4,3 | 0,0576 |
| Фосфорная | 7,9*10-3 | 2,89 | 1.6 | 0,0157 |
Относительные концентрации кислот, определяющие порог ощущения, могут сдвигаться в кондитерских изделиях с более интенсивным вкусом и при наличии в них веществ, маскирующих кислый вкус. Поэтому для подкисления тех или иных кондитерских изделий различными кислотами дозировку их следует устанавливать практически.
Приводим дозировку кислот (по Писареву) в карамели, дающих идентичный вкус (табл. 88).
Таблица 88. Дозировка кислот в карамели
| Кислоты | Идентичные по вкусу растворы кислот в г кислоты на 100 мл раствора | Идентичная по вкусу карамель при подкислении различными кислотами в % кислоты от веса карамели |
| Винная | 1,0 | 1,0 |
| Лимонная безводная | 1,2 | 1,1 |
| Молочная | 1.2 | 1,2 |
| Яблочная | 2,0 | 1,3 |
| Фосфорная | 0,56 | 0,4 |
Инвертирующая способность кислот различна, что следует учитывать при подкислении кондитерских изделий и особенно карамельной массы. Для ориентировочной оценки инвентирующей способности кислот в табл. 89 даны коэффициенты инверсии различных кислот по Оствальду. Числа этой таблицы представляют собой относительные величины констант скорости инверсии, причем значение для соляной кислоты принято за сто.
Таблица 89. Коэффициент инверсии различных кислот по Оствальду
| Кислоты | Коэффициент инверсии |
| Соляная | 100 |
| Фосфорная | 6,21 |
| Лимонная | 1,72 |
| Яблочная | 1,27 |
| Молочная | 1,07 |
Для приготовления инвертного сиропа, заменяющего крахмальную патоку, в качестве катализатора применяют соляную кислоту с последующей ее нейтрализацией.
Для этого должна применяться химически чистая или техническая соляная кислота, получаемая электролитически (ГОСТ 857-41).
Техническая кислота должна содержать:
а) соляной кислоты не менее 31%;
б) железа не более 0,01%;
в) мышьяка не более 0,0002%;
г) серной кислоты в пересчете на SO4 не более 0,005%.
Винная кислота
Винная (виннокаменная) кислота (С4Н6О6) — двуосновная диоксикислота. Товарная винная кислота представляет собой правовращающий ее изомер. Кристаллизуется она в виде бесцветных прозрачных призм моноклинической системы. Не имеет запаха, вкус резко выраженный кислый. Удельный вес 1,7598, молекулярный вес 150,09. Водный раствор вращает плоскость поляризации вправо. Для 20%-ного раствора угол вращения αD20— 12°.
Температура плавления винной кислоты 170°. Расплавленная кислота при застывании переходит в аморфную модификацию. При нагревании выше 170° две молекулы правой винной кислоты, отщепляя молекулу воды, переходят в двувинную, представляющую собой смолообразную массу.
Температура кипения при 1 атм 25%-ного раствора винной кислоты 102,2°, для 50 %-ного — 106,7°.
Винная кислота очень хорошо растворима в воде. Ее растворимость увеличивается с повышением температуры (табл. 90). В спирте она растворяется, но хуже. В эфире практически не растворима.
Таблица 90. Растворимость винной кислоты в зависимости от температуры
| Температура в °С | Содержание винной кислоты в % к раствору | Температура в °С | Содержание винной кислоты в % к раствору | Температура в °С | Содержание винной кислоты в % к раствору |
| 0 | 53,0 | 40 | 63,5 | 75 | 72,0 |
| 10 | 56,0 | 50 | 66,0 | 80 | 73,0 |
| 20 | 58,5 | 60 | 67,5 | 90 | 75,8 |
| 30 | 61,0 | 70 | 71,0 | 100 | 77,5 |
Зависимость удельного веса водных растворов винной кислоты от концентрации приводится в табл. 91.
Таблица 91. Зависимость удельного веса водных растворов винной кислоты от концентрации
| Удельный вес раствора | Количество винной кислоты в г/л | Удельный вес раствора | Количество винной кислоты в г/л | Удельный вес раствора | Количество винной кислоты в г/л |
| 1,004 | 8 | 1,100 | 207 | 1,220 | 422 |
| 1,007 | 15 | 1,108 | 223 | 1,231 | 439 |
| 1,014 | 31 | 1,116 | 239 | 1,243 | 456 |
| 1,022 | 47 | 1,125 | 255 | 1,252 | 473 |
| 1,029 | 63 | 1,134 | 271 | 1,263 | 490 |
| 1,037 | 79 | 1,142 | 283 | 1,274 | 507 |
| 1,045 | 95 | 1,152 | 303 | 1,285 | 524 |
| 1,052 | 111 | 1,162 | 320 | 1,293 | 541 |
| 1,060 | 127 | 1,171 | 337 | 1,308 | 558 |
| 1,067 | 143 | 1,181 | 354 | 1,326 | 575 |
| 1,075 | 159 | 1,190 | 371 | Насыщение | |
| 1,083 | 175 | 1,200 | 388 | — | — |
| 1,091 | 191 | 1,210 | 405 | — | — |
В табл. 92 приводится показатель преломления чистых растворов винной кислоты.
Таблица 92. Показатель преломления чистых растворов винной кислоты различных концентраций при температуре 20°
| Количество винной кислоты в 100 мл раствора в г | Показатель преломления | Количество винной кислоты в 100 мл раствора в г | Показатель преломления |
| 0,5 | 1,333 | 10,0 | 1,344 |
| 1,0 | 1,334 | 15,0 | 1,350 |
| 2,0 | 1,335 | 20,0 | 1,356 |
| 3,0 | 1,336 | 25,0 | 1,362 |
| 4,0 | 1,337 | 30,0 | 1,368 |
| 5,0 | 1,338 | 40,0 | 1,379 |
| 6,0 | 1,339 | 50,0 | 1,390 |
| 7,0 | 1,341 | Насыщенный | 1,420 |
| 8,0 | 1,342 | раствор | — |
| 9,0 | 1,343 |
Технические условия на винную кислоту. По стандарту![]()
винная кислота должна удовлетворять следующим требованиям.
- Внешний вид — бесцветные или со слабо-желтоватым оттенком, крупные или мелкие кристаллы и порошок.
- При растворении кислоты в дистиллированной воде должен получаться прозрачный раствор, не содержащий механических примесей и без запаха.
- Содержание винной кислоты в пересчете на сухое вещество не менее 99%.
- Посторонние примеси:
а) содержание золы не более 0,5%;
б) содержание тяжелых металлов не более 0,0005%, в том числе мышьяка не более 0,00014%;
в) содержание свободной серной кислоты не более 0,05%;
г) содержание соляной кислоты не более 0,02%;
д) соли свинца не допускаются.
Условия хранения. Хорошо высушенную винную кислоту следует хранить в сухом месте. Влажная винная кислота и ее растворы быстро разрушаются под действием различных микроорганизмов.
Лимонная кислота
Лимонная кислота (С6H8O7) — трехосновная оксикислота, кристаллизуется из водных растворов с одной молекулой воды в виде бесцветных прозрачных ромбических призм. Не имеет запаха, вкус явно выраженный кислый. Удельный вес безводной кислоты 1,54, молекулярный вес 192,12, молекулярный вес водной кислоты 210,14.
Температура плавления водной лимонной кислоты 70—75°, безводной—153°. При 100° водная кислота полностью теряет кристаллизационную воду. Обезвоженная лимонная кислота при перекристаллизации получается снова в безводной форме. При нагревании до 175° от молекулы лимонной кислоты отделяется одна молекула воды, и кислота превращается в ненасыщенную оканитовую кислоту.
Лимонная кислота хорошо растворима в воде, растворимость ее увеличивается с повышением температуры (табл. 93). Лимонная кислота растворима в спирте; в 100 частях 80%-ного спирта при 15° растворяется 87 частей водной лимонной кислоты; в 100 частях абсолютного спирта растворяется 43 части безводной кислоты.
Таблица 93. Растворимость лимонной кислоты в зависимости от температуры
| Температура в °С | Содержание лимонной кислоты в Н к раствору | Температура в °С | Содержание лимонной кислоты в % к раствору | Температура в °С | Содержание лимонной кислоты в % к раствору |
| 0 | 53,3 | 5 | 56,0 | 11 | 60,9 |
| 1 | 53,7 | 7 | 57,5 | 12 | 62,2 |
| 2 | 54,1 | 8 | 58,4 | 13 | 63,4 |
| 3 | 54,7 | 9 | 59,1 | 14 | 64,7 |
| 4 | 55,4 | 10 | 59,8 | 15 | 66,0 |
Зависимость удельного веса водных растворов лимонной кислоты от концентрации приводится в табл. 94.
Технические условия на лимонную кислоту. По стандарту (ГОСТ 908-41) лимонная кислота должна удовлетворять следующим требованиям.
В зависимости от способа кристаллизации пищевая лимонная кислота выпускается:
а) в мелких кристаллах;
б) в крупных кристаллах.
Кислота лимонная пищевая должна представлять собой бесцветные или со слабо-желтоватым оттенком кристаллы; слабые растворы (1—2%-ные) приятного кислого вкуса.
При растворении кислоты в дистиллированной воде должен получаться прозрачный раствор без запаха.
Зависимость удельного веса водных растворов лимонной кислоты от концентрации
| Удельный вес при 15°С | Количество лимонной кислоты в г/л | Удельный вес при 15°С | Количество лимонной кислоты в г/л | Удельный вес при 15°С | Количество лимонной кислоты в г/л |
| 1,0039 | 10,039 | 1,0931 | 251,413 | 1,1948 | 537,660 |
| 1,0074 | 20,148 | 1,0972 | 263,328 | 1,1998 | 551,908 |
| 1,0111 | 30,333 | 1,1016 | 275,400 | 1,2051 | 566,400 |
| 1,0149 | 40,596 | 1,1060 | 287,560 | 1,2103 | 580,944 |
| 1,0188 | 50,940 | 1,1106 | 299.862 | 1,2153 | 595,497 |
| 1,0227 | 61,362 | 1,1152 | 312,256 | 1,2204 | 610,200 |
| 1,0268 | 71,876 | 1,1198 | 324,742 | 1,2256 | 625,056 |
| 1,0309 | 82,472 | 1,1224 | 336,720 | 1,2307 | 639,964 |
| 1,0350 | 93,150 | 1,1288 | 349,928 | 1,2358 | 654,974 |
| 1,0392 | 103,920 | 1,1333 | 362,656 | 1,2410 | 670,140 |
| 1,0431 | 117,741 | 1,1378 | 375,474 | 1,2462 | 685,410 |
| 1,0470 | 125,640 | 1,1422 | 388,348 | 1,2514 | 700,784 |
| 1,0509 | 136,617. | 1,1438 | 400,330 | 1,2575 | 716,776 |
| 1,0549 | 147,686 | 1,1515 | 414,540 | 1,2627 | 732,366 |
| 1,0591 | 158,865 | 1,1563 | 427,831 | 1,2683 | 748,297 |
| 1,0632 | 170,112 | 1,1612 | 441,256 | 1,2738 | 764,280 |
| 1,0675 | 181,475 | 1,1661 | 454,779 | 1,2794 | 780,434 |
| 1,0718 | 192,924 | 1,1709 | 468,360 | 1,2848 | 796,576 |
| 1,0761 | 204,459 | 1,1761 | 488,201 | 1,2904 | 812,952 |
| 1,0805 | 216,100 | 1,1814 | 496,188 | 1,2960 | 829,440 |
| 1,0847 | 227,787 | 1,1856 | 509,808 | 1,3015 | 845,975 |
| 1,0889 | 239,558 | 1,1899 | 523,556 | 1,3071 | 862,686 |
Содержание лимонной кислоты должно быть не менее 99% во взятой навеске в пересчете на лимонную кислоту с одной молекулой кристаллизационной воды (С6Н807) • Н2О.
Посторонние примеси:
а) золы не более 0,5%;
б) серной кислоты (свободной) не более 0,05%;
в) мышьяка не более 0,00014%;
г) не должно содержаться алкалоидов и ионов: тяжелых металлов, железистосинеродистоводородной кислоты, бария и щавелевой кислоты.
Условия хранения. Лимонная кислота должна храниться в
сухом помещении. При транспортировке необходимо предохранять от увлажнения.
Яблочная кислота
Яблочная кислота (С3H6O5) или оксиянтарная—двуосновная оксикислота, получаемая из растительного сырья (махорки), представляет собой левовращающий ее изомер. Она кристаллизуется в виде игл с температурой плавления 100°. Хорошо растворима в воде.
Синтетическая яблочная кислота представляет собой рацемическое соединение правой и левой яблочных кислот. Она кристаллизуется легче левовращающей, менее растворима в воде, плавится при более высокой температуре (130—131°). Молекулярный вес 134,09; удельный вес левовращающей 1,595, рацемической 1,601. Левовращающая разлагается при нагревании свыше 140°, а рацемическая свыше 150°. Растворимость рацемической модификации в воде при 26° — 144 весовых частей в 100 весовых частях растворителя, а при 79°—411. В спирте и эфире легко растворяется.
Технические условия на яблочную кислоту те же, что и на лимонную.
Молочная кислота
Молочная кислота (С3Н603) — одноосновная оксикислота. Существует два вида молочной кислоты: α-оксипропионовая или
этилиден-молочная кислота (СН3СНОНСООН) и β-оксипропионовая или этилиден-молочная кислота (СН2ОНСН2СООН). Промышленное значение имеет этилиден-молочная кислота, получающаяся при молочнокислом брожении в виде рацемической смеси. Молекулярный вес молочной кислоты 90,08.
В кристаллическом виде молочная кислота может быть получена при осторожном выпаривании под высоким вакуумом водного раствора молочной кислоты. Кристаллы при атмосферном давлении плавятся, образуя бесцветную сиропообразную жидкость удельного веса 1,21, без запаха с резко кислым вкусом.
Молочная кислота является нестойким химическим соединением. В зависимости от условий производства и хранения она легко образует продукты дегидратации, обычно объединяемые под общим названием ангидридов молочной кислоты.
Все продукты дегидратации, за исключением димолочной кислоты, являются соединениями менее ценными во вкусовом отношении, чем свободная молочная кислота, так как кислые свойства ее обусловливаются свободной карбоксильной группой.
При нагревании молочной кислоты до 90° образуется главным образом лактилмолочная кислота, до 100—110° в значительных количествах ди-, три-, тетра- и пенталактилмолочные кислоты, а при нагревании в вакууме до 180—250° — лактид.
Водный раствор молочной кислоты представляет собой равновесную систему![]()
Состав смеси зависит от концентрации молочной кислоты: чем она выше, тем большее количество в ней ангидридов.
Молочная кислота и ее ангидриды растворяются в воде, спирте и эфире во всех отношениях. Удельный вес химически чистой молочной кислоты при 18° 50%-ной — 1,16; 90%-ной — 1,21.
На кондитерские фабрики молочная кислота поступает в виде водных растворов с концентрацией кислоты 40—70% и в виде пасты, в которой около 10% кислот связано в кристаллический лактат кальция, который механически связывает молочную кислоту в твердую пасту.
Технические условия на молочную кислоту. По стандарту (ГОСТ 490-41) молочная кислота по качественным показателям, независимо от концентрации, подразделяется на кислоту І, II и III сорта.
Кислота должна удовлетворять следующим требованиям.
Быть прозрачной, без мути осадка (допускается для кислоты II и III сорта наличие опалесценции или осадка, исчезающих при разведении дистиллированной водой 1:1).
Цвет:
а) кислота I сорта должна быть бесцветной или слабо-желтого цвета;
б) кислота II сорта может иметь цвет от желтого до желтокоричневого;
в) кислота III сорта может иметь цвет от желтого до темно- коричневого.
Запах и вкус:
а) кислота не должна иметь неприятного острого запаха, обусловленного присутствием в ней примесей летучих кислот;
б) в 1%-ном водном растворе кислота должна обладать чистым кислым вкусом без постороннего привкуса.
Химические показатели:
а) в зависимости от концентрации и сорта кислота характеризуется показателями, которые приведены в табл. 95.
Таблица 95
| Сорт | Прямо- титруемая молочная кислота в %, не менее | Прямоне- титруемая молочная кислота в %, не более | Зола в %, не более | Азот в %, не более | Цветность, не более | |||||
| при концентрации в % | ||||||||||
| 40 | 70 | 40 | 70 | 40 | 70 | 40 | 70 | 40 | 70 | |
| I | 37,5 | 62 | 2.5 | 8 | 1,0 | 1,5 | 0,15 | 0,25 | 1:100 | 1:25 |
| II | 36,5 | 59 | 3,5 | 11 | 2,0 | 3,0 | 0,25 | 0,45 | 1:75 | 1:15 |
| III | 35,5 | 55 | 4,5 | 15 | 3,0 | 4,5 | 0,45 | 0,80 | 1:40 | 1:10 |
Примечание. Цветность определяется сравнением окраски молочной кислоты с окраской раствора, полученного смешением 0,1 N раствора йода и дистиллированной воды в соотношениях, указанных в табл. 95;
б) при реакции на свободную серную кислоту с метилвиоле- том в растворе молочной кислоты не должен появляться зеленый оттенок;
в) железа в пересчете на Ре203 и 100%-ную молочную кислоту должно быть не более 0,05%;
г) кислота молочная не должна содержать цианистоводородной кислоты, мышьяка, солей тяжелых металлов (свинца, меди) и солей железистосинеродистоводородной кислоты.
Использованная литература
Журавский Г. И., Новоселова Л. В., Елисеев М. И., Вулихмаи А. А., Захарова Г. С., Производство пищевых кислот, Пищепромиздат, 1953.
Кислота лимонная пищевая ГОСТ 908-41.
Кислота молочная пищевая ГОСТ 490-41.
Писарев Н. С., Кислоты и вопросы инверсии, гигроскопичности и цветности в карамельном производстве, издание ВНИТО кондитеров, 1938.
Справочник химика, т. I, Госхимиздат, 1951.
Чичибабин A. E., Органическая химия, Гостехиздат, 1953.
Landolt-Börnstein, Zahlenwerte und Functionen aus Physik, Chemie, Astronomie Geophysik und Technik, Berlin, 1952.
Ароматизаторы
Характеристика ароматизаторов
Аромат кондитерским изделям сообщается натуральными ароматизирующими и синтетическими веществами. При введении ароматических веществ изделиям сообщается определенный вкус.
К натуральным ароматическим и вкусовым веществам относятся изделия из бобов какао (тертое какао, шоколад, порошок какао), жареное кофе, орехи, ваниль, фруктово-ягодные припасы и вина. К натуральным ароматическим веществам относятся и эфирные масла, выделенные из различных эфироносов растительного происхождения.
К синтетическим душистым веществам относятся ароматизаторы, полученные методами органической химии из полуфабрикатов растительного происхождения и полностью синтетических продуктов.
Некоторые ароматические вещества могут быть отнесены как к натуральным, так и к синтетическим, в зависимости от способа их получения.
Пищевыми ароматическими эссенциями называются ароматизаторы, представляющие собой спиртовые, водно-спиртовые или ацетиновые растворы смесей натуральных и синтетических душистых веществ. Они составляются по рецептурам, утвержденным Министерством промышленности продовольственных товаров Украины по согласованию с Государственной санитарной инспекцией Украины.
Эссенции для кондитерской промышленности выпускаются однократной, двукратной и четырехкратной концентрации.
Пищевые эссенции должны храниться в плотно закрытой стеклянной таре в условиях, исключающих доступ солнечных лучей.
Длительность хранения пищевых эссенций 6 месяцев.
Эссенции разливают в стеклянные бутыли емкостью до 25 л. Бутыли помещают в корзины, клетки или деревянные ящики с крышками и прокладывают соломой, стружками или опилками.
Установление запаха и вкуса
Запах и вкус ароматизаторов устанавливается при дегустации изготовляемых изделий. При этом запах и вкус эссенций лучше всего определять при дегустации (в сахарном сиропе) 0,2% раствора эссенции, а эфирных масел и синтетических душистых веществ — 0,03% раствора или взвеси.
Эфирные масла
В кондитерской промышленности можно применять следующие эфирные масла, если они входят в рецептуру.
Анисовое масло получают из плодов аниса. В состав масла входит до 90% анетола. Содержится в количестве 2,2—3,2% к весу плодов.
Грейпфрутовое масло получают из свежей кожуры плодов. В состав масла входит около 90% d-лимонена. Масло содержится в количестве 0,06% к весу цельных плодов.
Померанцевое масло извлекают из кожуры плодов Citrus aurantium L. subsp. amara L. в количестве 0,15% к весу кожуры. Масло содержит более 90% d-лимонена.
Апельсиновое масло получается из кожуры плодов Citrus sinensis в количестве 0,3%. Масло содержит более 90% d-лимонена.
Мандариновое масло извлекают из кожуры мандаринов. Выход масла составляет 0,75—0,85% к весу цельных плодов. Это масло состоит главным образом из d-лимонена.
Масло перечной мяты отгоняют из перечной мяты. Выход от 0,3 до 1,0%. Оно содержит не менее 50% ментола.
Масло кудрявой мяты получают из кудрявой мяты в количестве от 0,7 до 1,5%. Оно содержит карвон, линалоол и линалилацетат.
Кориандровое масло получают из высушенных семян в количестве 0,8—1,1%. Основной составной частью масла является линалоол (60—80%)\
Отдельные ароматизаторы
Ванилин (4-окси-З-метоксибензальдегид)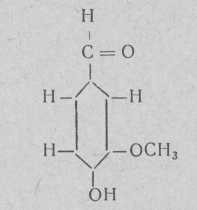
(плавления 80,5—81,5°,
Температура кипения 285° (не разлагается в токе углекислого газа).
Растворяется в водных растворах углекислого и двууглекислого натрия. Перекристаллизовывается из воды.
Бурбонал (ванилаль) (4-окси-З-этоксибензальдегид)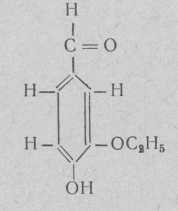
Температура плавления 77—78°.
Для кондитерских изделий не рекомендуется вследствие цветочного запаха.
Диацетил
СН3 — СО — со — CH3.
Применяется в кондитерском производстве для сообщения продуктам запаха коровьего масла. Со спиртом и эфиром смешивается во всех отношениях. Растворяется при 15° в 4 объемах воды.
Изоамиловый эфир коричной кислоты
(СН3)2 = СН — СН2— СН2 — О — ОС — СН — СН — С6Н5.
Применяется для усиления аромата бобов какао.
Ментол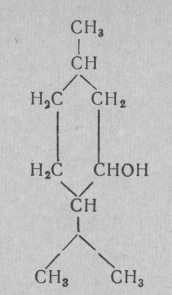
Т плавления 42,5°,
Температура кипения 216°
Кристаллизуется в бесцветных иглообразных и колонкообразных кристаллах гексагональной системы, которые обладают характерным мятным запахом и охлаждающим вкусом. В воде растворяется плохо, в спирте, серном эфире, хлороформе, жирных и эфирных маслах — хорошо.
Кумарин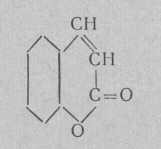
Обладает запахом сена. Плавится при 67°. Применяется как добавка к другим ароматизаторам для получения характерного аромата.
Использованная литература
Горяев М. И., Характеристика химических соединений, входящих в состав эфирных масел, под ред. проф. Г. В. Пигулевского, АН Казахской ССР, 1953.
Кондрацкий А. П. и Сокольников Н. П., Руководство для лаборантов эфиромасличных предприятий, Пищепромиз- дат, 1953
Обухов А. Н. и Кондрацкий А. П., Технология эфиромасличного производства, Пищепромиздат, 1946.
Студнеобразователи
Студнеобразующие вещества (студнеобразователи) применяются в кондитерской промышленности для приготовления студнеобразных изделий (мармеладов, пастилы, зефира, «желейных» конфет).
В кондитерской промышленности Советского Союза в качестве студнеобразователей используются агар, пектин и агароид.
Зарубежные кондитерские фабрики в качестве студнеобразователей применяют также желатин, альгиновую кислоту (и ее соединения), карраген-экстракт и др.
Характерной чертой веществ этой группы является их способность к образованию при определенных условиях студней (гелей), особенность которых заключается в том, что они легко принимают любую придаваемую им форму, образуя при этом более или менее прочную структуру.
Агар
Агар — растительный клей, содержащийся в багряных морских водорослях (рода Анфельтиа, Гелидиум и др.), произрастающих в прибрежных водах Белого моря и Тихого океана.
Для извлечения агара предварительно подготовленные водоросли (подсушенные, очищенные от песка и ила, от моллюсков и ракушек, замоченные и промытые), вываривают в горячей воде с добавлением щелочи. Полученный отвар (агаровый бульон) фильтруют, охлаждают до полного застуденения, подвергают резке, дополнительной очистке и последующему обезвоживанию сушкой или вымораживанием.
В химическом отношении агар представляет высокополимерное соединение типа полисахаридов, имеющее цепеобразную молекулу. Отдельные звенья ее состоят из остатков галактозы.
В составе рыночных препаратов агара, кроме галактозы, присутствуют обычно кальций, магний, сера (органически связанная), калий, натрий, фосфор и азот в виде тех или иных соединений.
После деминерализации агара (удаления Са, Мg, K, Nа) получается сложный органический комплекс, состоящий, по предположениям, основанным на данных исследований последнего времени, из серного эфира линейного полисахарида, имеющего следующую формулу:
В агаровую цепь входят 9 остатков d-галактозы, связанных между собой 1 : 3 глюкозидной связью. Цепь заканчивается остатком L-галактозы, который связан с предшествующими звеньями цепи через свой атом углерода 4, шестой же атом углерода его эфиризован серной кислотой.
Агар почти нерастворим в холодной воде, но набухает в ней как коллоид ограниченного набухания (при этом воздушно-сухой агар связывает воду в 4—10-кратном количестве к его весу).
При кипячении в воде агар растворяется почти полностью.
Из водных растворов агар может быть осажден спиртом, ацетоном и электролитами.
Горячий водный раствор агара (золь) переходит при остывании в студень (гель), отличающийся стекловидным изломом. Для получения прочного студня, поддающегося резке ножом, достаточно от 0,3 до 1% агара к весу водного раствора (в зависимости от способности к студнеобразованию данного образца агара).
При введении в агаро-водный раствор сахара получаются студни, прочность которых возрастает с повышением концентрации сахара и с уменьшением содержания воды.
Агаро-сахаро-водные студни обладают известной устойчивостью в отношении нагревания. При подкислении этих студней стойкость их в отношении нагревания резко снижается. В присутствии кислоты в студне происходит гидролиз агара, который ослабляет его способность к студнеобразованию. Деградация студнеобразующей способности агара в кислой среде развивается особенно интенсивно при повышении температуры среды, начиная с 60—70°.
Согласно действующему ГОСТу 6470-53 агар может выпускаться в продажу в виде пористых пластин толщиной не более 20 мм, пленки толщиной не более 0,5 мм, крупки, хлопьев, порошка.
Цвет его от белого (для высшего сорта) до желтого и светло- коричневого (для I сорта).
Агар и его водные растворы не должны иметь постороннего запаха и вкуса.
Влажность агара должна быть не более 18%. Для агара, полученного методом вымораживания, влажность допускается до 20%
Содержание золы в агаре высшего сорта должно быть не более 4,5%, в I сорте—не более 7%.
Количество азотистых веществ соответственно до 1 и 2%.
Способность агара к студнеобразованию характеризуется по нагрузке, которую выдерживает стандартный студень (0,85% абсолютно сухого агара, 70% сахара, 29,15% воды). Она должна быть не менее 1000—1400 г по прибору Валента для определения прочности студня.
Температура плавления 0,85%-ного водного студня агара должна быть не ниже 80°, а температура застуденения его не ниже 30°.
В условиях кондитерского производства температура застуденения 1%-ного студня агара, содержащего 60—70% сахара (и около 1% винной или лимонной кислоты), находится в пределах 35— -40°.
Важное значение при использовании агара в кондитерской промышленности имеет высокая степень очистки его, в частности — отсутствие окраски (что необходимо для создания бесцветного фона изделий), отсутствие постороннего запаха и вкуса.
Агар должен быть упакован в деревянные ящики (выложенные внутри плотной бумагой), вес нетто которых не более 20 кг, или в картонные коробки весом нетто не более 10 кг.
Агар нужно хранить в сухом, хорошо проветриваемом складе, не имеющем резких колебаний температуры и при относительной влажности не более 80%
Срок хранения агара один год.

Останні коментарі